DERIVAT ASAM KARBOKSILAT
l Reaksi Turunan Asam Karboksilat
1. Subtitusi kelompok asil
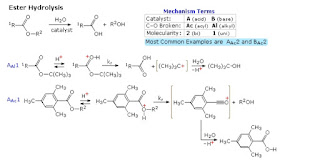
Ini merupakan satu-satunya reaksi terpenting dari turunan asam karboksilat. Transformasi keseluruhan ditentukan oleh persamaan berikut, dan dapat diklasifikasikan sebagai sibstitusi nukleofilik pada gugus asil atau asilasi nukleofil. Untuk reagen nukleofilik tertentu, reaksi dapat menggunakan nama lain juga. Jika Nuc-H adalah air, maka reaksinya yang sering disebut dengan hidrolisis., jika Nuc-H adalah alkohol reaksinya disebut alkoholisis, dan untuk amonia dan amina disebut aminolisis.
Turunan asam karboksilat yang memiliki reaktivitas yang sangat berbeda, asil klorida dan bromida menjadi yang paling reaktif dan amida yang paling tidak reaktif, seperti yang telah dicatat dalam daftar urutan kualitatif berikut. Perubahan reaktivitas sangat dramatis. Dalam sistem pelarut homogen, reaksi asil klorida dengan air terjadi dengan secara cepat, dan tidak memerlukan pemanasan atau katalis. Amida, sebaliknya bereaksi dengan air hanya dengan adanya katalis asam atau basa kuat dan pemanasan eksternal.
Reaktivitas: asil halida> anhidrida>> ester = asam >> amida
Karena perbedaan inilah konversi satu jenis turunan asam menjadi turunan asam lainnya umumnya dibatasi seperti yang diuraikan daslam diagram berikut. Metode untuk mengubah asam karboksilat menjadi turunan tetapi sediaan amida dan anhidrida
tidak umum dan membutuhkan pemanasan yang kuat. Sintesis anhidrida yang lebih baik dan lebih umum dapat dicapai dari asil klorida, dan amida dengan mudah dibuat dari salah satu turunan yang lebih reaktif.
Reaksi asilasi umumnya berlangsung melalui proses eliminasi adisi dimana reaktan nukleofilik berikatan dengan atom karbon karbonil elektrofilik untuk membuat zat antara tetrahedral. Bahan antara tetrahedral ini kemudian mengalami eliminasi untuk menghasilkan produk. Dalam mekanisme dua tahap pembentukan ikatan terjadi sebelum pemutusan ikatan, dan atom karbon karbonil mengalami perubahan hibridisasi dari sp2 ke sp3dan kemballi lagi. Fasilitas yang ditambahkan reagen nukleofilik ke gugus karbonil telah dicatat sebelumnya untuk aldehida dan keton.
Jumlah langkah individu dalam mekanisme ini bervariasi, tetapi karakteristik esensial dari transformasi keseluruhan adalah penambahan diikuti dengan eliminasi. Katalis asam bertindak untuk meningkatkan elektrovitasnya. Pada prinsipnya semua langkah dapat dibalik tetapi dalam praktiknya banyak reaksi semacam ini tidak dapat diiubah kecuali terjadi perubahan pada reaktan dan kindisinya. Pembentukan ester yang dikatalisasi asam dari asam karboksilat dan alkohol, adalah contoh yang baik dari reaksi asilasi yang dapat dibalik, produk ditentukan dengan penambahan atau penghhilangan air dari sistem. Reaksi asil klorida dengan alkohol juga menghasilkan ester, tetapi konversi ini tidak dapat dibalik dengan menambahkan HCl ke dalam campuran reaksi.
Dalam reaktivitas turunan asam karboksilat yang berbeda, subtituen karbonil yang membedakan dalam senyawa ini adalah : kloro ( asil klorida ), asiloksi ( anhidrida ), alkoksi ( ester ) dan amino ( amida ). semua substituen ini memiliki ikatan yang berasal dari atom dengan elektronegativitas yang relatif tinggi ( Cl, O & N ) oleh karena itu, secara induktif menarik elektron saat terikat pada karbon.
PERMASALAHAN
1. Konversi langsung asam karboksilat menjadi amida sulit karena amina sangat basa dan cenderung mengubah asam karboksilat menjadi ion karboksilat yang sangat tidak reaktif. Oleh karena itu, DCC (Dicyclohexylcarbodiimide) digunakan untuk mendorong reaksi ini,lantas apakah ada senyawa selain DCC ini yang bisa membentuk senyawa amida?
2. Pada reaksi hidrolisis yang saya paparkan ester terhidrolisis baik dalam suasana basa menghasilkan fragmen asam karboksilat dan alkohol. Bagaimana pada reaksi hidrolisis ester ini jika dilakukan dalam suasana asam? Apakah akan menghasilkan produk yang sama yaitu asam karboksilat dan alkohol?
3. Dikatakan bahwasanya semua derivat asam karboksilat mengandung gugus asil, RCO-, kecuali nitril. Dengan adanya perbedaan tersebut, maka apa yang membedakan senyawa nitril dibandingkan senyawa derivat asam karboksilat lainnya?